Kinderkardiologische Gemeinschaftspraxis in Braunschweig
Dr. med. Jens Bahlmann und Frau Dr. Urte Grosser
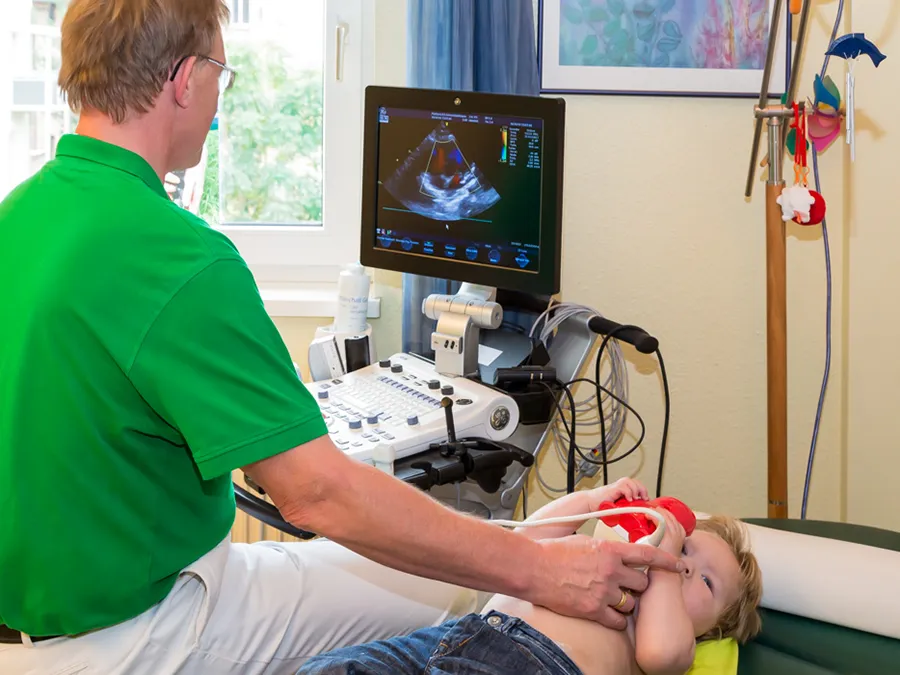
Wir wollen sie mit unserem Internetauftritt über unsere Praxis und unser Leistungsspektrum informieren. Unser Schwerpunkt liegt in der Betreuung von Menschen mit angeborenen Herzfehlern (Kinder und Erwachsene) sowie in der kinderkardiologischen Betreuung. Letztere umfasst nicht nur die Abklärung und Betreuung bei einem angeborenen Herzfehler, sondern auch z. B. die Abklärung bei Herzrhythmusstörungen, Brustschmerzen, Schwindel, Bewusstseinsverlust, erhöhten Blutfettwerten und hohem Blutdruck. Als eine der ersten Praxen in Deutschland sind wir zertifiziert für die Behandlung von Erwachsenen mit angeborenen Herzfehlern (EMAH).
Liebe Kolleginnen und Kollegen, geschätzte Patienten,
nach fast 40-jähriger kinderärztlicher Tätigkeit und über 25 Jahren
„Kinderkardiologische Praxis“ Braunschweig
möchte ich mich hiermit bei Ihnen in meinen Ruhestand verabschieden.
Zum 31.03.2024 werde ich aus der Praxis ausscheiden und die Betreuung meiner „Herzchen“ an meine Nachfolgerin Frau Dr. Urte Grosser übergeben.
Herr Dr. Jens Bahlmann wird, jetzt als „Senior-Chef“, selbstverständlich weiter für Sie ansprechbar sein.
Auf diesem Wege möchte ich mich bei Ihnen allen für die stets gute und kollegiale Zusammenarbeit bedanken und wünsche mir, dass Sie das in uns entgegengebrachte Vertrauen auch der Praxis in neuer Besetzung entgegenbringen.
Meinen Praxissitz übernimmt Frau Dr. med. Urte Grosser. Sie ist eine langjährige Oberärztin aus der Kinderkardiologie der Medizinischen Hochschule Hannover unter Leitung von Prof. Beerbaum und hat dort über zehn Jahre die Ambulanz geleitet. Zusätzlich hat sie die Zusatzqualifikation Spezielle Kardiologie für Erwachsene mit angeborenen Herzfehlern erworben. Sie wird also auch wie Dr. Bahlmann unsere erwachsen gewordenen Patienten mit angeborenen Herzfehlern weiter betreuen.
Weiterhin unterstützt wird die Praxis von Frau Dr. Jutta Koll, die sich mittlerweile im letzten Weiterbildungsjahr zur Kinderkardiologie befindet.
So verbleibe ich mit meinem letzten „mit HERZlichen Grüßen“
Ihr Dr. med. Eberhard Griese
Als fachärztliche kinderkardiologisch tätige Praxis führen wir zurzeit keine allgemeinpädiatrische Regelversorgung von Kindern durch.
Seit Kurzem bieten wir auch die Diagnostik und Betreuung von Kindern mit Entwicklungsauffälligkeiten und Lernproblemen (Sozialpädiatrie, Psychosomatik) sowie schweren chronischen Erkrankungen im Rahmen unserer Praxis an.
Differentialdiagnostisch kann bei belastungsabhängiger Luftnot oder auch anderen Belastungsproblemen eine Diagnostik mittels Lungenfunktion und Spiroergometrie erfolgen.
Ein weiterer Schwerpunkt liegt in der sportmedizinischen Untersuchung von Kindern und Jugendlichen. Diese soll die jungen Sportler vor Risiken im Rahmen ihrer sportlichen Betätigung schützen und ihnen durch jährliche Kontrollen eine sportmedizinische Sicherheit bei der Ausübung ihres Sportes geben.
Leistungen
Schauen Sie sich hier unsere Übersicht der Leistungen der kinderkardiologischen Praxis in Braunschweig an.
Patienten
Liebe Patienten, es ist uns ein Anliegen jeden unserer Patienten individuell und schnellstmöglich zu behandeln.
Ärzte & Zuweiser
Sehr geehrte Kollegen und Zuweiser, wir danken für Ihr langjähriges Vertrauen und ihre Zuweisungen.

Unser Anliegen ist eine individuelle patienten- und elternbezogene Betreuung auf Augenhöhe. Lange Wartezeiten auf einen Termin sollen bewusst vermieden werden und liegen zurzeit deutlich unter den Wartezeiten der kinderkardiologischen Fachkollegen. Auch versuchen wir im Rahmen der allgemeinen Sprechstunde ihren Aufenthalt im kindgerechten Wartezimmer möglichst kurz zu halten. Für Säuglinge gibt es einen separaten Wartebereich. Kinder mit akuten Erkrankungen erhalten einen Termin innerhalb von 24-48 Stunden. Neugeborene mit Herzproblemen werden innerhalb von 24 Stunden behandelt. Es besteht ein kinderkardiologischer Konsiliardienst für alle umliegenden Geburts- und Kinderkliniken.
Wir wünschen Ihnen nun ein interessantes „surfen“ auf unserer Internetseite und freuen uns auf eine persönliche Begegnung mit Euch/Ihnen in unserer Praxis.
Ihr Team der kinderkardiologischen Praxis Braunschweig
Praxisrundgang
Praxisrundgang
Praxisrundgang
Mitbringsel
Überweisung und Chipkarte
Befunde früherer Herzuntersuchungen/ Operationen o.ä.
Medikamente, die ständig oder gelegentlich eingenommen werden
Unterlage für die Liege (Schonung der Umwelt durch Vermeidung von Papiermüll oder Waschorgien)
Bei Belastungsuntersuchung ein Handtuch





